近日,上海交通大学药学院研究员、荣灿生物和上海交通大学药学院院企联合实验室的负责人章雪晴教授受邀参与RANScript Webinar直播分享,在直播中,章雪晴教授分享的题目是《可吸入核酸纳米药物研发进展和应用前景》,首先带大家回顾了核酸药物的发展历程,分析了已上市的核酸药物,评价了不同的给药方式。重点通过对肺部核酸递送及可吸入制剂的分析,并总结了可吸入制剂需穿过生物学屏障和细胞内屏障的难点。
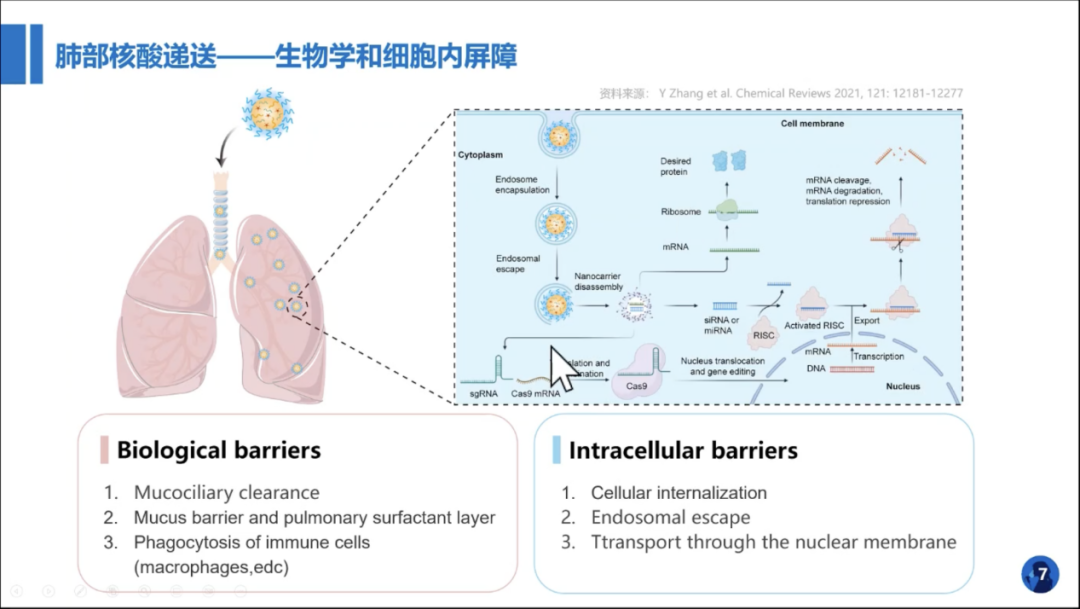

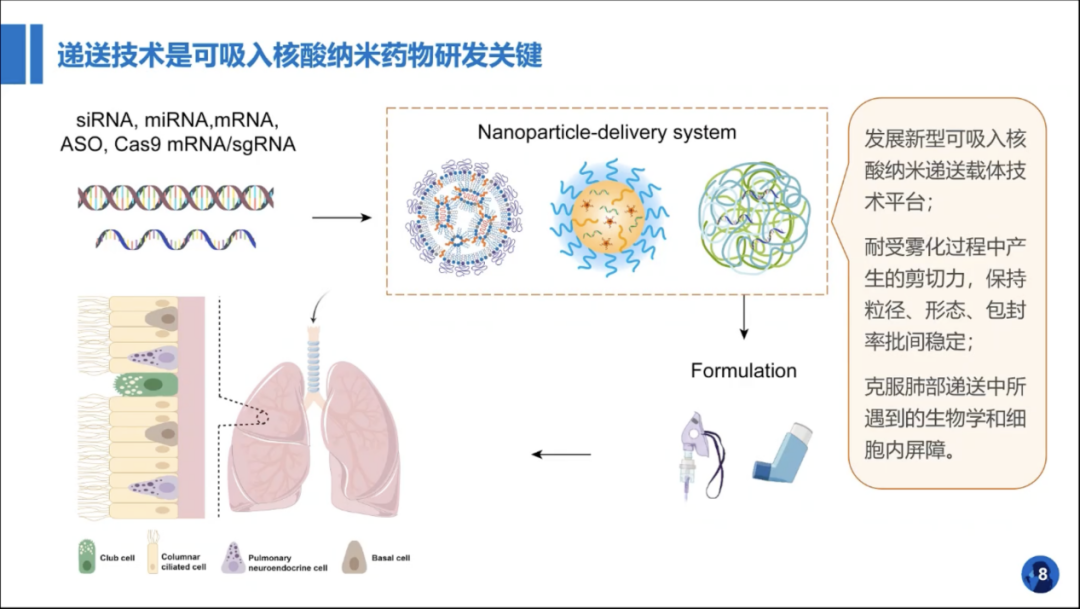
通过对可吸入核酸纳米载体的设计以其在抗肺纤维化新药研发的应用的分享,为大家讲解了可吸入核酸纳米药物的作用机制、递送技术的筛选及雾化制剂稳定性分析等。
此外,章老师还通过IPF模型小鼠对药物在体内药理过程及作用机制分析进行了探讨。通过完整的药物开发过程,突出了可吸入纳米载体递送药物的肺组织特异性、研发周期短、应用广泛的特点,强调了创新型核酸药物开发对肺纤维化的重要临床和经济价值。
问答环节
以下为RANScript Webinar讨论环节,听众与章老师进行的系列探讨与交流的摘录,可谓问得精妙答得专业:
Q:siRNA本身稳定性很好,可以直接雾化递送到肺部,为何还要费大力气去制备LNP包裹呢?
A:肺部递送不仅是有细胞内的屏障,实际上还是有一些胞外的屏障,包括如何通过细胞黏膜,如何通过肺泡表面的表面活性物质,如何透过上皮屏障,这些问题siRNA本身是不能够实现的。
Q:当LNP用于可吸入mRNA疫苗递送载体时,PEG-lipid的含量往往特别高,请问如何解决PEG-lipIid在体内产生抗PEG抗体引起的毒副作用?
A:与James E Dahlman文章中的组分相比,目前我们使用的PEG的含量并不是特别高。虽然比经典四组分中LNP的含量高,不过,我们在小鼠动物模型中,并没有观察到不良反应。你的问题是一个非常不错的建议,目前我们并没有在血清中检测PEG的抗体,之后的试验中会考虑这个方向。
Q:您在进行肺纤维化项目时使用的雾化装置是自己公司开发的还是商业化产品?不同的雾化装置对mRNA-LNP的理化参数和体内结果有影响吗?
A:我们采用的是商用的雾化器,装在公司定制的雾化装置上。不同雾化装置对体内结果的影响还在研究中,下阶段会对这个方面进行探索。
Q:mRNA-LNP体内和体外评价时,往往体外和体内结果的相关性特别差,是不是就看体内结果就行了?在新型可电离脂质及其新LNP设计开发时还需要在细胞层面进行筛选吗?
A:刚开始也尝试先采用细胞进行筛选,发现体外与体内相关性确实不太好。现在基本是以体内为主,一般来讲,在动物层面中转染效果好的样品在体外转染效果也不错,但通过体外验证的方法在体内试验效果不一定会好。最终的作用效果也是需要在动物中验证,所以我们目前采用的是动物体内试验的方法。当然,如果有其他的方式也欢迎大家交流。
Q:请问细胞层面的实验主要是通过直接在培养基中加入药物进行检测的吗?
A:我们并不是直接检测的。我们采用的方式是在纳米粒子雾化后收集至离心小管中,然后制备成液体样品,再进行检测,同时也考量了雾化过程是否对药物产生了影响。
Q:请问您制备LNP的微流控小试和中试设备是什么品牌?
A:之前实验室都是自己搭建,定制芯片。我们实验室尝试过PNI等的多种小试设备,中试的设备是定制设计和搭建的。建议根据不同的载体进行尝试,选择设备,比较合理。我们从手搭到最后的定制,也经历了漫长的摸索过程。
Q:可吸入RNA和注射用RNA的修饰方式一样吗?
A:是不一样的,脂质化合物也不一样。
Q:siRNA本身稳定性很好,可以直接雾化递送到肺部,为何还要费大力气去制备LNP包裹呢?
A:雾化过程会产生剪切力,会破坏纳米结构,也会产生稳定性、包封率降低等问题,通过制剂及制备工艺调节都可以克服。比如可以选择剪切力较小的雾化器,选择表面张力较低的分散体系等。可吸入液体制剂对于可吸入纳米制剂研发也具有借鉴价值。
Q:方便分享包封率的方法吗?
A:我们还是用的荧光检测法,“mRNA行业交流群”里有不少科研工作者分享的包封率检测法,我看到很多同行分享的SOP是非常好的,以后也欢迎大家在群内交流。
最后,章雪晴老师的导师毛海泉教授(美国约翰斯霍普金斯大学材料系及生物医学工程系教授、纳米生物技术研究所副所长)新近开发了一种表征LNP的新方法,这对LNP制剂的基础研究与监管都极为重要,因而,RNAScript主编崔雯雯博士借此机会邀请章老师为大家做了简单的解读:

推荐阅读:Nature 子刊|LNP表征新方法!助力FDA 等评估机构实现mRNA的有效载荷表征,精准评估药物有效性
章老师精彩点评
目前在LNP制剂的相关研究中,mRNA的包载多以宏观的包封率量化。而关于mRNA在单个LNP中的载量、分布、以及空载纳米粒的含量等研究工作却鲜少报导。毛海泉教授和王泽辉教授团队基于多激光圆柱形照明共聚焦光谱(CICS)技术,通过荧光标记LNP配方中的不同物种,开发了一种能够从单颗粒水平表征mRNA荷载特征的分析平台。该方法通过荧光检测的方式区分复杂纳米粒系统中的空载LNP,载mRNA的LNP以及游离mRNA,定量分析单颗粒分辨率下的mRNA有效载荷分布和容量,以及其他脂质辅料的含量。利用这一技术平台,研究团队系统研究了PEG 含量、N/P比、mRNA浓度和mRNA大小等参数对DLin-MC3-DMA LNP中mRNA载量和分布的影响,并基于实验数据提出了关于mRNA分子在制备过程中如何分布到LNP中的详细动力学组装机制。
研究团队发现,在pH 7.4条件下,低PEG含量使亲脂性mRNA复合物能够克服能量壁垒相互融合,从而显著增加mRNA的有效载荷量;高N/P比时,空LNP与mRNA LNP的融合是动力学有利事件,最终稳定的LNP含有相对较少的mRNA有效载荷;另外,mRNA有效载荷容量和分布对mRNA和脂质的浓度不敏感,但可能与一定质量的核酸相关,每个LNP的mRNA拷贝数与mRNA大小呈负相关。
这项技术具有高通量筛选和微型采样量的特性,为mRNA LNP生产过程中的质量研究和过程管控提供了一种高效且可靠的检测手段。这项研究成果也将助力于研究人员理解结构-属性-功能关系以进一步优化LNP制剂,在mRNA LNP新药研发中发挥至关重要的作用。

