☆ 具备独立自主知识产权mRNA核心技术的公司均具备了技术平台的特质。
☆ 实现国内mRNA产业化,在关键技术上要有突破,包括mRNA递送载体技术、mRNA的加帽加尾、序列优化及核酸修饰技术等。
☆ 国内mRNA研发上游的核酸原料供应商已经具备一定的产业化生产能力,而下游的生产设备领域与国际水平存在较大差距。
新年伊始,辉瑞与Beam Therapeutics即宣布了一项重磅合作,双方将共同开发体内单碱基编辑产品用于罕见病治疗。后者作为基因编辑领域鼎鼎大名的创业公司,具备领先的单碱基编辑技术平台,可通过递送载体(LNP)将编码碱基编辑组分的信使RNA(mRNA)及向导RNA(gRNA)递送到人体指定位置,实现单碱基编辑。
虽然Beam目前还未有利用该技术开发的体内单碱基编辑产品获批开展临床研究,但鉴于辉瑞在mRNA新冠疫苗商业化的成功经验,外界亦对mRNA这一全新应用场景充满遐想。
mRNA应用遍地开花
事实上,目前在研的mRNA“另类”产品不止这一项。在肿瘤免疫、蛋白替代疗法、再生医学、细胞疗法等各个领域,mRNA的身影都开始频繁出现。
如在肿瘤免疫方面,已有多个基于新抗原的肿瘤疫苗进入临床研究阶段,包括Moderna的mRNA-4157、BioNTech的BNT111等,BNT111还于去年底获得FDA授予的快速通道资格。另外,mRNA正被开发用于调节肿瘤微环境,如Moderna的mRNA-2752,这是一款编码三种免疫调节因子OX40L/IL-23/IL-36γ的局部注射mRNA的肿瘤免疫疗法。
对于同样是新兴技术的细胞免疫疗法,mRNA也对此带来革新。有公司正尝试使用mRNA改造T细胞来表达CAR。还有更超前的做法,宾夕法尼亚大学科学家在Science上发表文章CAR T cells produced in vivo to treat cardiac injury,提出可在不将T细胞取出体外的情况下,利用 mRNA 在体内实现对 T 细胞的功能化修饰。
业界目前已充分认识到mRNA的应用潜力。国际医药巨头如辉瑞、礼来、GSK、赛诺菲等,以及国内较为知名的大型制药公司如恒瑞、石药、君实、康希诺等,都相继开展mRNA产品线相关布局。这些药企有的参与当下热门的新冠疫苗研发,有的结合公司自身的特长,将mRNA应用于肿瘤、传染病、罕见病、心血管疾病等多种不同适应症。
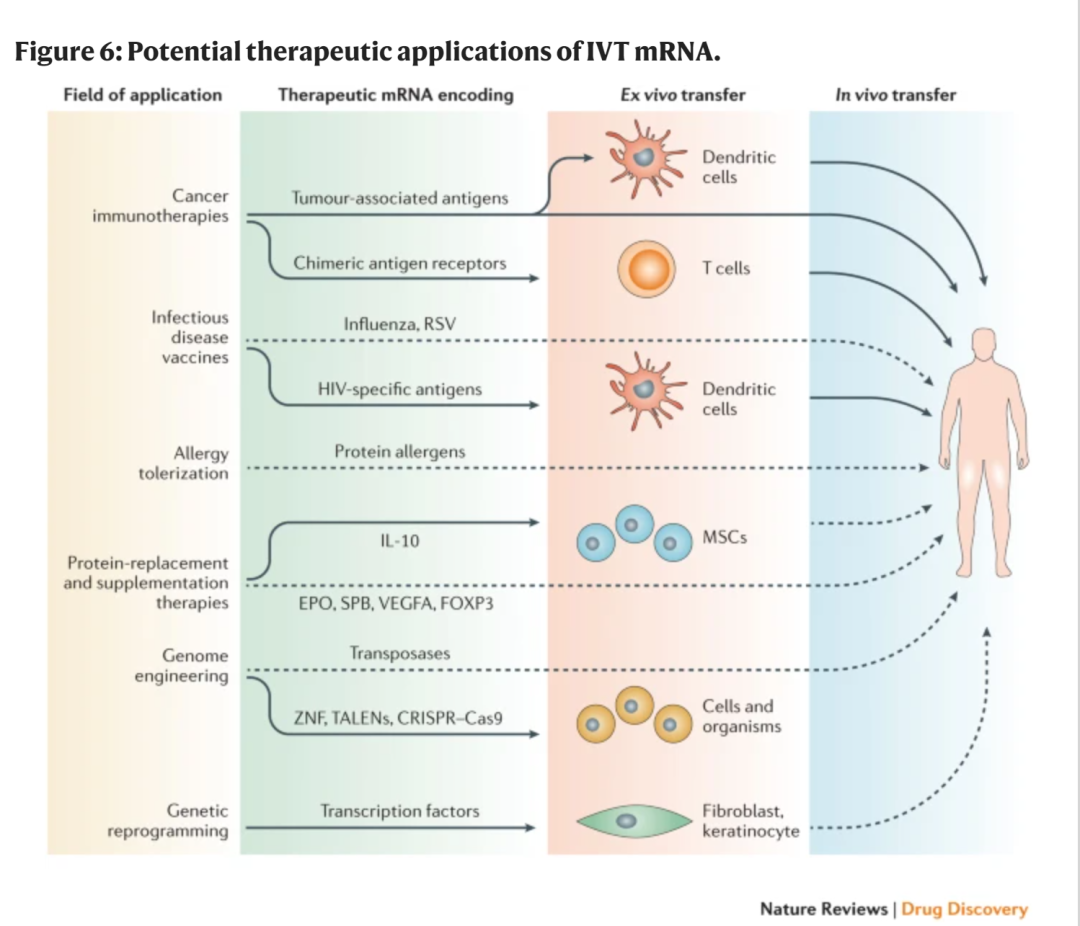
mRNA技术潜在应用范畴
来源 | Nature
据此预测,未来mRNA的应用会更加广泛,越来越多的疾病将会有mRNA治疗药物。
此外,mRNA技术有望大幅提升新药研发速度,并让部分复杂的治疗手段变得简单,这方面同时会给企业和患者都带来获益。新药研发速度加快,如Moderna新冠疫苗从立项到获批临床仅6个月,企业可以更快有产品上市并从中获得投资回报;而mRNA降低原本治疗手段的相对复杂性,如肿瘤疫苗、蛋白替代疗法等的实现难度,也会直接提高患者对于新疗法的可及性,并降低使用成本。
BioNTech公司CEO Ugur Sahin博士就专门谈到过这个问题,其提到公司产品线中的个性化肿瘤疫苗,目前在二代基因测序(NGS)的帮助下,从序列发现到 mRNA 肿瘤疫苗问世,仅需 3~5 周的时间,较之前的蛋白疫苗生产时间大幅缩短。这对于癌症患者紧迫的治疗需求而言是一个重要的改进。
mRNA研发平台核心技术
与此同时, mRNA技术还呈现出另一项特点——技术平台特质及很强的延展性。目前,Moderna的mRNA产品线已有40个在研(含已上市)产品,BioNTech与mRNA有关的产品也有18个。Moderna总裁认为,未来10年其公司产品有望再扩充10倍。这样的产品线规模在生物技术公司中是非常罕见的,事实上这两家公司的产品线已广泛覆盖了众多疾病类型(详见下表)。
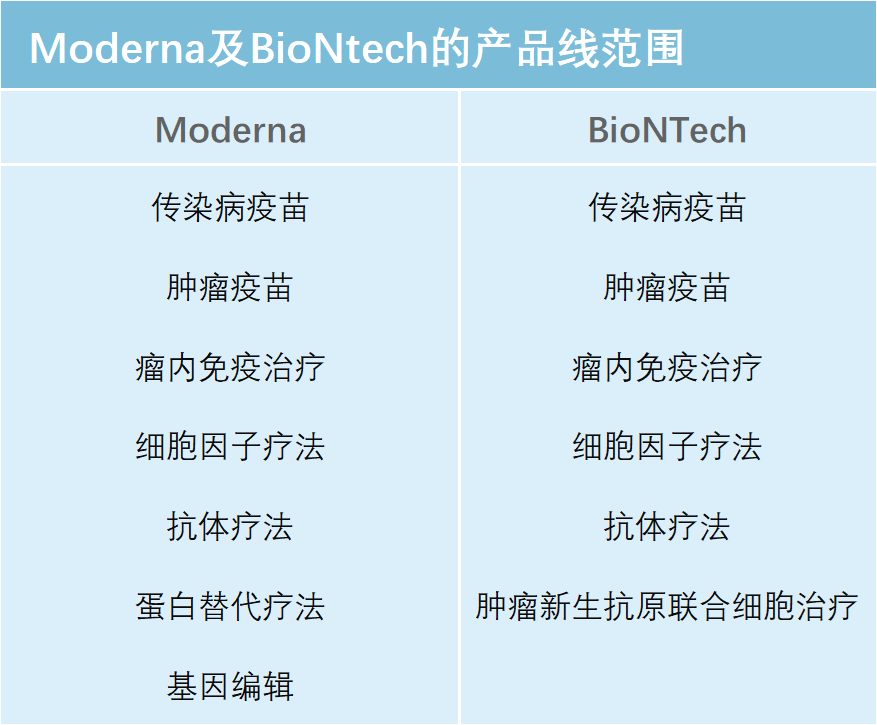
可以说,具备独立自主知识产权mRNA核心技术的公司均具备了技术平台的特质,这也是Moderna、BioNtech这几家新锐Biotech公司和众多传统国际医药巨头开展合作的底气和实力之所在。
至于哪些是mRNA产品开发的核心技术,本文就此采访了荣灿生物从国外知名研究机构回国的mRNA研发专家。该专家认为,国内要实现 mRNA产业化,站在国际mRNA生物技术潮头,最重要的是控制产品的稳定性、安全性和转染效率。在关键技术上要有突破,包括mRNA递送载体技术、mRNA的加帽加尾、序列优化及核酸修饰技术等。这些技术不少国外公司已提前布局了专利。
首先是mRNA的加帽方式,有加帽酶和共转录两种方法。前者目前国内外都可以公开使用,但后者的专利掌握在TriLink手中,且由于后者实现的工艺流程更简单、质控更易把握,行业逐渐开始倾向使用这一加帽方法。加尾(Poly-A尾)方法则主要来自公开文献,但对于药品生产而言,如何控制加尾后腺嘌呤(A碱基)的数量,是质控的难点也是关键点。
核酸修饰方面,也是比较具有挑战的一个方向,这方面国外公司及研究机构已经筑起了较高的专利壁垒。如为增加mRNA的稳定性,并减少免疫原性对mRNA使用安全的影响,会对mRNA序列中的尿嘧啶碱基进行修饰。其中一种修饰方法是将尿嘧啶替换为假尿嘧啶,该专利掌握在宾夕法尼亚大学和美国NIH手中,同时Moderna、辉瑞以及BioNTech也在这方面开发出了不同的尿嘧啶修饰手段,并已申请专利。不过新冠疫苗研发目前获得了该专利的豁免权,但在mRNA的其他用途上专利仍然有效。
此外,还有一项被认为是Know-How的技术即mRNA序列优化,包括mRNA序列的二级结构、密码子选择以及不同碱基出现的频率控制等。这项技术没有单独的专利,但对于mRNA翻译蛋白质的效率以及稳定性的提高非常关键。
如mRNA分子中,同义密码子CAA、CAG均可翻译谷氨酰胺,但人类基因组中使用CAG频率更高,因此mRNA序列中CAA的过多出现会一定程度上降低相应蛋白的翻译效率。而一条由数百乃至数千碱基组成的mRNA,其序列优化存在大量的可能情况,需要人工智能计算平台协助才可完成,因此这也成为mRNA研发企业的技术核心。
在mRNA序列产生后,就轮到LNP载体发挥作用了,其需要递送mRNA进入细胞并安全高效地翻译目标蛋白,对于mRNA研发企业而言,这可能是当下最难解决的一个技术难题,所以全球主要的mRNA疫苗研发企业都曾使用过Arbutus授权的LNP载体专利。
目前国外公司还在mRNA这几项关键技术领域修筑更宽的护城河。最近辉瑞的几项合作,除了开发新产品亦显示其正在努力补齐自身的mRNA技术平台短板,公司在与Beam以及Acuitas的合作中,都提到了LNP载体。
这两家公司均拥有LNP递送载体。Beam在递送方面的布局非常全面,同时具备电穿孔、LNP载体及腺相关病毒(AAV)等多种递送方法,可以满足mRNA在人体多种细胞和器官的递送。其为了提升递送载体的开发能力还专门收购了 Guide Therapeutics,后者具备为LNP贴上DNA分子标签的技术,可以跟踪LNP是否将有效载荷传递到指定细胞位置并发挥作用。该方法可以实现同时对数以千计的LNP载体进行筛选。
Moderna和BioNTech则都致力于开发mRNA序列优化云计算平台。以Moderna 的mRNA Design Studio为例,科学家只要输入抗原蛋白质靶标,就能自动得到初始优化后的mRNA 序列,并通过Sequence Designer 模块完成从5'UTR→编码区→3'UTR 的整个mRNA 构建。在新冠疫苗mRNA 序列设计中,Moderna与NIH从中国学者公布病毒基因测序结果到设计完成mRNA 疫苗序列仅用时一天。
此外对于已经公开的技术,如mRNA的加尾方法,也有企业对其作进一步优化,形成自己的技术。如辉瑞与BioNTech发现,如果在Poly-A尾中嵌入其他的核苷酸序列,则可能进一步提高mRNA的稳定性。
国内公司如何迎头赶上
从国外mRNA研发企业的行动看,各家都希望实现在mRNA关键技术上的自主可控。但国内mRNA产业化起步晚,目前在递送系统、核酸修饰等核心技术上具备专利的企业还很少。
以5'端的加帽为例。根据曹丽荣等人发表的《mRNA疫苗5'帽结构技术专利现状研究》提供的数据,截至2021年4月,全球mRNA 疫苗5'端帽结构技术专利,在美国申请的有128件,占比74.9%;在中国申请的仅9件,占比只有5.1%。去年Nature Biotechnology上发表的另一篇文章分析了与新冠mRNA疫苗有关的专利分布,提到了全球几十家公司和研究机构,但中国公司均没有在列。
不过从长远看,中国在mRNA技术发展方面的滞后可能不会一直存在。
首先中国的mRNA技术发展此前并非一片空白,采访专家提到国内高校一直没有停止对于mRNA的研究,只是这些研究多数停留在实验室阶段,没有考虑将技术作为药物开发并使其产业化。但为了实现突破,推动产学研,也有企业率先走出了第一步。
例如,荣灿生物2020年就与上海交通大学共建了实验室,直接推进mRNA的实验室研发向产业化方向转化,并取得了一定成就。
目前资本和人才都在加速推动国内mRNA的产业化。国外有大量与mRNA药物研发相关的人才回国或采用兼职的模式,他们不少都在核酸修饰、生物信息学以及LNP递送系统开发等方面有长期的研究积累,因此在疾病治疗需求的推动下,这些技术有望未来在新药研发上取得突破。
同时国内部分mRNA研发企业也加快在核心技术方面的布局,并想方设法打破国外公司的专利限制。前述荣灿mRNA研发专家向研发客介绍了公司在这方面的系列布局。
荣灿生物最大的技术优势在于LNP递送载体。其有自己的LNP研发平台,同时拥有多个不同的LNP专利。荣灿在LNP上的开发理念与上文提到的Beam有些类似,其筛选了多个可以用于不同应用场景的LNP品种,具有一定的器官靶向性包括肺定向给药等。
国内知名疫苗研发企业就荣灿生物正在研发的新冠变异株疫苗使用的LNP载体的细胞安全性、转染效率、抗体水平和中和活性进行了第三方测试,测试结果达到了国际头部企业辉瑞LNP载体的相关技术水准。就LNP载体合作,荣灿生物已与国内疫苗头部研发公司建立合作。目前也有国际医药巨头就载体合作、一类mRNA创新药研发合作正与荣灿生物进行接洽。
此外,荣灿生物设计了一款通用型的质粒模板。使用这一模板生成不同的mRNA,每次仅需替换编码蛋白翻译的序列,其他部分如5'UTR和3'UTR及Poly-A尾都可以保持不变。
“将这样的质粒模板应用于mRNA合成,不用每个新产品都从头开始设计整个mRNA序列,这可以节约大量的时间,”荣灿方面提到,“该模板已被验证可高效表达不同的蛋白,目前公司还在针对模板的5'UTR和3'UTR部分作进一步的优化。”
同时,荣灿生物将技术平台的打造向mRNA序列设计及核酸修饰方面延伸。受访专家提到公司目前一方面正与核苷酸原料合成企业合作,共同商讨针对尿嘧啶碱基新的修饰方法,以期绕开国外的碱基修饰专利;另一方面正在开展合成环状RNA的研究,这也是为避开国外公司在碱基修饰方面的专利限制。
“环状RNA不需要使用修饰的碱基就能保持结构的稳定,反而使用修饰的碱基会影响蛋白的翻译效率。”今年荣灿还定立了新的目标,准备开发公司内部的mRNA序列优化云计算平台。
国内mRNA研发的上下游企业也在为产业发展提供支持。上游即核酸原料供应商,已经具备一定的产业化生产能力。如mRNA生产相关的酶原料制造,中国已有部分公司为国外的mRNA疫苗开发提供酶原料,这意味着产品质量得到认可。而对比于国外的原料供应企业,中国企业具有较大的成本优势,未来产量提升价格还可能进一步降低。
但在下游企业即生产设备提供方面,由于国内过去在mRNA产业化方面比较薄弱,这一领域与国际水平还是存在较大差距。
国内已有药械企业转向mRNA制造设备的研发生产,但据行业反馈,目前产品制造的批次差及质量与国际水平相比还有较大的改善空间。然而国外的设备购买成本非常昂贵,等候时间较长,这些都有可能影响国内mRNA的产业化发展。
同时,由于脂质化合物的物化性质以及LNP配方各异,对脂质纳米颗粒包裹mRNA的设备要求也不同,通用型设备在精度上还有很大提升空间,目前Moderna、BioNtech用的都是定制化设备。受访专家希望国内公司能在这类产业化设备、仪器的研发上多下功夫。
事实上,就国外mRNA公司的成立时间而言,国外mRNA的产业化也不过才十来年。因此除国际头部公司外,国内外大多数mRNA公司的发展应该都还处于类似的起跑线上,如果此时国内企业奋起直追,并不会有太多劣势。只是中国的mRNA公司需要重视源头创新,提升自身科技实力,打造全产业链平台,从而在全球mRNA竞赛中赢得一席之地,实现第三代生物技术弯道超车。
作者:研发客
链接:https://mp.weixin.qq.com/s/_8Nbb9r3mnqU7IWX3eAy6Q
来源:微信公众号
著作权归作者所有。商业转载请联系作者获得授权,非商业转载请注明出处。
风险提示:本文所提到的观点仅代表个人意见,所涉及标的不作推荐,据此买卖,风险自负。

