特发性肺纤维化 (idiopathic pulmonary fibrosis, IPF) ,是进行性的间质性肺病并伴有持续的肺功能损伤。目前全球约有500万人患有IPF,平均中位生存期为3-5年。然而迄今为止的上市药物仅有吡非尼酮和尼达尼布,且为FDA弱推荐药物,存在巨大未满足的临床需求。
2022年6月22日,上海交通大学药学院章雪晴教授团队联合新泽西理工学院许晓阳教授团队在Science Advances上发表了题为Inhaled siRNA nanoparticles targeting IL11 inhibit lung fibrosis and improve pulmonary function post-bleomycin challenge的研究论文。基于可吸入的核酸纳米递送载体,成功递送小干扰RNA(siRNA)到达纤维化小鼠的肺部,实现肺纤维化的治疗。

IPF的病理机制十分复杂,肺泡上皮细胞反复受损后纤维化通路被异常激活,导致成纤维细胞的激活和细胞外基质的过度沉积。白介素11(interleukin 11, IL-11)是一种有效的促纤维化细胞因子,其与受体结合后,通过ERK信号通路引起多种器官的纤维化。在本项目中,研究人员通过免疫组化染色观察到博来霉素诱导的肺纤维化小鼠模型的肺组织中 IL-11 和ACTA2(肌成纤维细胞标记物)的显著上调,并通过定量分析发现两者之间存在高度相关性,由此确定IL-11 作为IPF治疗的潜在药物靶点。
siRNA具有治疗各种疾病的巨大前景, 但目前上市 siRNA 药物全部使用肝部递送技术, 尚无上市载体能将 siRNA 安全有效的递送到非肝器官或组织。本研究利用脂质化合物制备的纳米粒包载针对IL11的siRNA (siIL11)得到siIL11@PPGC NPs,具有以下突出优势:1) 具有良好的稳定性,能承受雾化过程中产生的剪切力并维持雾化前后的粒径、形貌、细胞摄取和包封率不变;2)可浓缩成小体积;3) 雾化后穿过肺黏液层到达肺组织深处。
体外实验表明,siIL11@PPGC NPs可以显著抑制成纤维细胞向肌成纤维细胞的转化,细胞外基质的沉积以及成纤维细胞的迁移。在博来霉素诱导的小鼠肺纤维化模型中,雾化吸入的siIL11@PPGC NPs能够有效降低ACTA2和COL1A1的表达,显著降低羟脯氨酸含量并改善纤维化面积和胶原含量。该纳米药物不仅抗纤维化效果显著,而且显著改善肺纤维化小鼠的肺功能,为修复肺组织损伤和干预肺纤维化后的功能恢复提供新的治疗方法。siIL11@PPGC NPs沉默IL-11的表达,抑制ERK磷酸化,在介导抗纤维化治疗中发挥了重要作用。
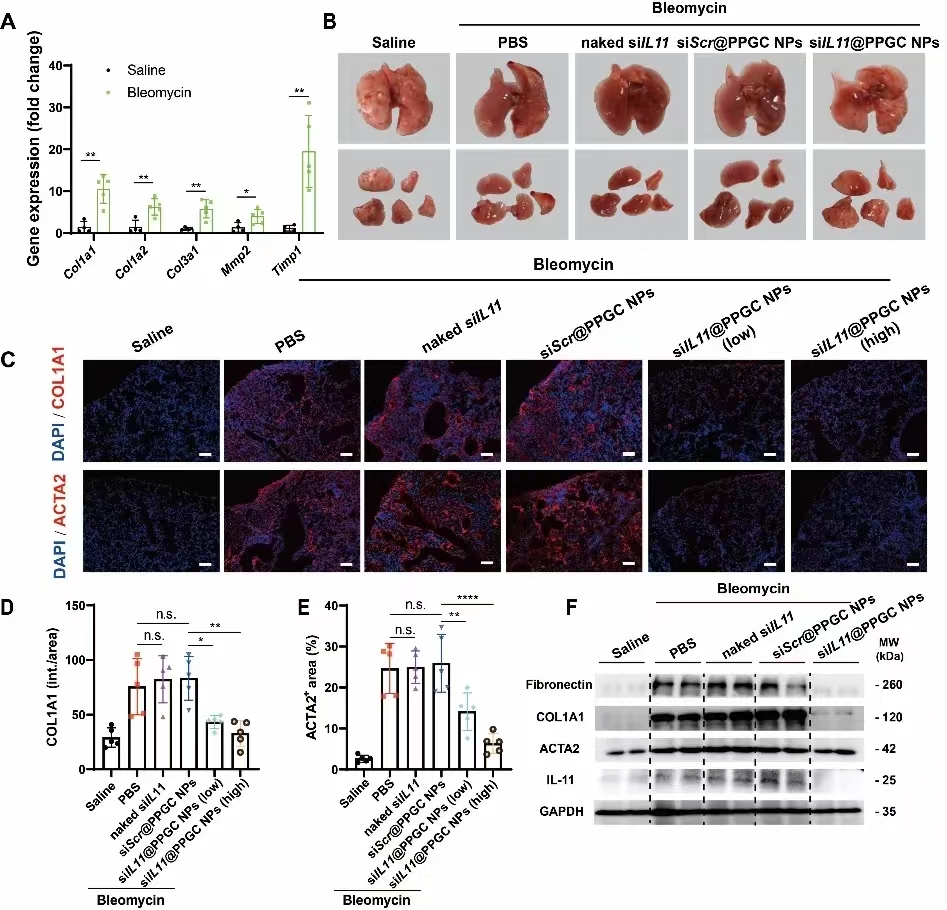
部分动物数据。A, 造模前后基因比较;B, 肺组织表面形态;C-E, 免疫荧光代表性图像和定量结果;F, 免疫印迹分析。
该研究中采用的纳米粒经吸入给药后,沉积在整个细支气管和肺泡上皮中,大大提高依从性并减少全身暴露,为肺纤维化的治疗提供了巨大契机。此种可吸入核酸递送纳米载体,实现靶向递送治疗核酸分子至肺部,为探索目前被定义为治疗肺部疾病的“难以成药”的靶点提供了潜在的机会,在治疗包括 IPF 在内的多种呼吸系统疾病方面表现出巨大的临床应用前景。
据悉,以本研究为基础,章雪晴教授团队在可吸入核酸纳米递送系统的研发上不断迭代优化,目前已形成更加安全有效的第二代可吸入核酸递送载体,并应用到抗肺纤维化的核酸纳米药物开发的转化工作中。
上海交通大学柏欣博士为该论文的第一作者,上海交通大学药学院为第一和通讯单位。
链接:https://mp.weixin.qq.com/s/RFZYq11Ed5pu9FZ6UiCU0Q
来源:BioArtMED微信公众号

